摩登7平台注册 传奇彩票快3

BINOL 及其衍生物是不对称合成中应用最广泛的配体类型之一,可被用于多种反应,包括 Diels-Alder、羰基加成和还原、迈克尔加成以及其他多种反应。尽管使用 BINOL 催化体系已经取得了巨大成功,但其他 C2对称二元醇配体也引起了一些关注。其中包括 Wulff 及其同事开发的拱形双芳基配体。事实证明,拱形3,3'-联苯酚(VAPOL)和拱形 2,2'-联萘酚(VANOL)都是催化不对称 Diels-Alder、亚胺醛和氮丙啶化反应的极佳配体。(图1)[1]。近期,VAPOL的磷酸衍生物被证明是一种有效的手性Brønsted酸催化剂。在这里所示的许多实例中,拱形联芳基比使用BINOL配体在相同的反应中具有更高的产率和诱导率。

图1.
不对称DIELS–ALDER反应
在很早期的时候,由Et2AlCl和VAPOL生成的催化剂被证明是不对称Diels-Alder反应的一种有效催化剂[2]。如方案1所示,在VAPOL衍生的催化剂存在下,丙烯醛与环戊二烯的环加成反应可在很高的光学纯度下实现外型异构体的高转化率和极佳的立体选择性。通过BINOL衍生的催化剂而进行类似反应可得到高产率的环状化合物,但ee值却非常低(13-41%)。

方案1.
不对称氮杂环丙烷化反应
氮杂环丙烷是有机合成中的重要组成部分,因为它们可以实现胺、氨基醇、二胺和其他有用含氮分子的便捷获取。现在的许多手性氮杂环丙烷的制备方法都依赖于手性池。最近,Wulff小组已经发现了一种可靠的催化型不对称氮杂环丙烷化反应,可提供高产率和选择性的光学活性氮杂环丙烷。该反应依赖于在由拱形芳基配体和B(OPh)3制备的芳基硼酸酯催化剂存在下,将重氮乙酸乙酯(EDA)添加到二苯甲基亚胺上[3]。该氮杂环丙烷化反应对顺式异构体显示出了极好的选择性,并获得了较高的ee值。所生成的苯甲酰基保护的氮杂环丙烷经历了各类反应,包括:脱保护、还原性开环或烷基化反应(方案2,表1)。白细胞整合素LFA-1拮抗剂BIRT-377的不对称合成利用的就是一种叠氮/烷基化方法,可以以极高的总产率提供乙内酰脲靶标。
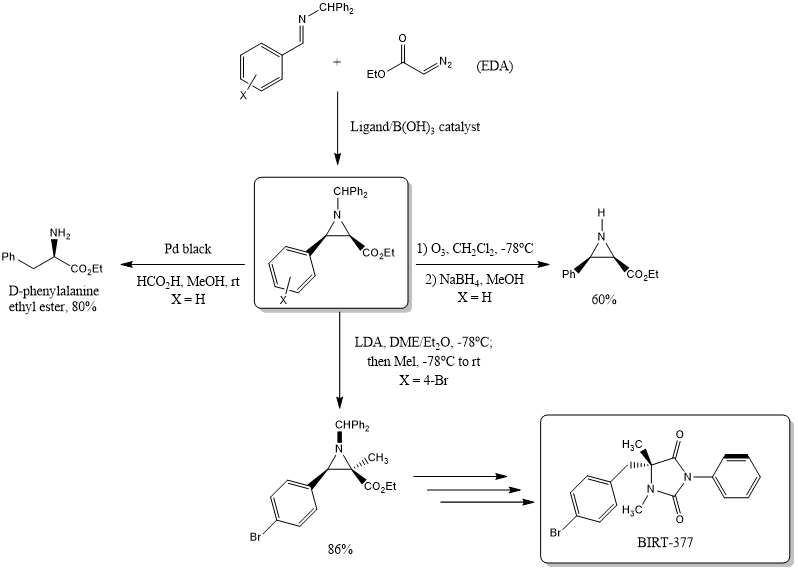
方案2.
|
表1.
抗菌剂(-)-氯霉素的快速合成利用的是不对称的叠氮化反应,以及随后氮杂环丙烷与二氯乙酸的亲核开环和后续的酰基迁移(方案3,表2)。VANOL和VAPOL与BINOL衍生的催化剂相比均能得到更高的产率和更好的立体选择性。

方案3.
|
表2.
(*产物是所示氮丙啶的对映体)
不对称羟醛反应
不对称亚胺羟醛反应也可被拱形联芳基衍生的催化剂催化,为合成手性β-氨基酯提供了一种重要的方法。在Zr-VANOL或Zr-VAPOL催化剂的存在下,向芳基亚胺上添加甲硅烷基乙烯酮缩醛会促进高度不对称的诱导反应并得到极佳的产率(方案4,表3)。重要的是,两种催化剂都比类似的BINOL衍生的催化剂表现出了更显著的诱导水平[4]。

方案4.
|
表3.
手性BRØNSTED酸
Antilla及其同事证明了,在向Boc活化的芳基亚胺上添加磺酰胺类化合物时,VAPOL磷酸氢盐是一种有用的手性Brønsted酸催化剂(方案5)[5]。所得到的N,N-缩醛胺产物具有高产率以及惊人的对映体纯度。利用BINOL衍生的Brønsted酸催化剂而进行的相同反应可得到极佳的产率(95%),但手性控制却比较差(<5%ee)。多种磺酰胺和芳基亚胺可在亚胺酰胺化反应中具有活性,且所得的受保护的缩醛胺属于耐贮存的化合物。

方案5.
参考文献
1. Bao J, Wulff WD, Dominy JB, Fumo MJ, Grant EB, Rob AC, Whitcomb MC, Yeung S, Ostrander RL, Rheingold AL. 1996. Synthesis, Resolution, and Determination of Absolute Configuration of a Vaulted 2,2’-Binaphthol and a Vaulted 3,3’-Biphenanthrol (VAPOL). J. Am. Chem. Soc.. 118(14): 3392-3405. https://doi.org/10.1021/ja952018t
2. (a) Bao J, Wulff WD, Rheingold AL. 1993. Vaulted biaryls as chiral ligands for asymmetric catalytic Diels-Alder reactions. J. Am. Chem. Soc.. 115(9): 3814-3815. https://doi.org/10.1021/ja00062a073
(b) J B, W. D W. 1995. Angew. Chem., Int. Ed. 2000, 39, 4518. Tetrahedron Lett.. 36, 3321.
(c) D. P. et al H. 1997. J. Am. Chem. Soc. 119, 10551.
3. (a) J. C A, W. D W. 1991. J. Am. Chem. Soc.. 121, 5099.
(b) J. C A, W. D W. 2000. Angew. Chem., Int. Ed. 2000, 39, 4518.
(c) A. P. et al. P. 2005. Org. Lett. 2005, 7, 2201.. Org. Lett 7, 2201.
4. S. et al. X. 2001. Angew. Chem., Int. Ed. .40, 2271. https://doi.org/10.1002/1521-3757(20010618)113:12<2331::AID-ANGE2331>3.0.CO;2-P
5. Rowland GB, Zhang H, Rowland EB, Chennamadhavuni S, Wang Y, Antilla JC. 2005. Brønsted Acid-Catalyzed Imine Amidation. J. Am. Chem. Soc.. 127(45):15696-15697. https://doi.org/10.1021/ja0533085
 首页
首页 400-620-6333
400-620-6333



 危险品化学品经营许可证(带存储)
危险品化学品经营许可证(带存储)